De tyrosinekinase
Wat is een tyrosinekinase?
Tyrosinekinase is een specifieke groep enzymen die vanuit biochemisch oogpunt functioneel zijn toegewezen aan proteïnekinasen. Eiwitkinases dragen omkeerbaar (mogelijkheid van omgekeerde reactie) fosfaatgroepen over naar de OH-groep (hydroxylgroep) van het aminozuur tyrosine. De fosfaatgroep wordt overgebracht naar de hydroxylgroep van de tyrosine van een ander eiwit.
Door deze beschreven omkeerbare fosforylering kunnen tyrosinekinasen een beslissende invloed hebben op de activiteit van eiwitten en daarom een belangrijke rol spelen in signaaltransductieroutes. Vooral therapeutisch, bijvoorbeeld in de oncologie, wordt de functie van tyrosinekinasen gebruikt als een doelwit voor geneesmiddelen.

De taak en functie
Tyrosinekinasen moeten eerst worden onderverdeeld in membraangebonden en niet-membraangebonden tyrosinekinasen om te begrijpen hoe ze werken.
Membraangebonden tyrosinekinasen kunnen hun eigen proteïnekinaseactiviteit hebben, waarbij de kinasefunctie wordt geactiveerd als onderdeel van het receptorcomplex op het celmembraan.Anders kunnen membraangebonden tyrosinekinasen functioneel worden gekoppeld aan het receptorcomplex, maar kunnen ze er niet direct in worden gelokaliseerd. Het tyrosinekinase en de receptor vormen een binding waarmee via de receptor een bepaald signaal wordt doorgegeven aan het kinase.
In het geval van een niet-membraangebonden tyrosinekinase, bevindt dit zich in het cytoplasma of in de kern van een cel. Afhankelijk van het structurele ontwerp met een bijbehorende functie kunnen verschillende voorbeelden van tyrosinekinasen worden genoemd. Voorbeelden van membraangebonden tyrosinekinasen zijn de insulinereceptor, de EGF-receptor, de NGF-receptor of de PDGF-receptor. Dit toont aan dat de signaalcascades met behulp van tyrosinekinasen vitale processen zijn in het menselijk lichaam.
De insulineafgifte uit de alvleesklier bij maaltijden wordt gereguleerd via de insulinereceptor. De EGF-receptor heeft specifieke bindingsplaatsen voor verschillende liganden, waaronder het EGF of TNF-alfa het vermelden waard zijn. Als eiwitligand speelt de EGF (epidermale groeifactor) een uitstekende rol als groeifactor (celproliferatie en differentiatie). TNF-alfa is daarentegen een van de krachtigste ontstekingsmarkers in het menselijk lichaam en speelt een belangrijke diagnostische rol bij de diagnose van ontsteking.
PDGF is op zijn beurt een groeifactor die wordt afgegeven door trombocyten (bloedplaatjes), die wondsluiting induceert en volgens huidig onderzoek ook bijdraagt aan de ontwikkeling van pulmonale hypertensie.
Voorbeelden van niet-membraangebonden tyrosinekinasen zijn de ABL1- en de Janus-kinasen.
Bij een tyrosinekinase verloopt een signaalcascade met bepaalde informatie in principe altijd op dezelfde stereotiepe manier. Ten eerste moet een geschikte ligand binden aan een receptor, die zich meestal op het oppervlak van cellen bevindt. Deze koppeling wordt meestal tot stand gebracht via een congruente eiwitstructuur van ligand en receptor (lock and key-principe) of via binding aan bepaalde chemische groepen van de receptor (fosfaat-, sulfaatgroepen, enz.). De koppeling verandert de eiwitstructuur van de receptor. Vooral bij tyrosinekinasen vormt de receptor homodimeren (twee identieke eiwitsubeenheden) of heterodimeren (twee verschillende eiwitsubeenheden). Deze zogenaamde dimerisatie kan leiden tot een activering van tyrosinekinasen die, zoals hierboven reeds vermeld, zich direct in de receptor of aan de cytoplasmatische zijde (gericht naar de binnenkant van de cel) van de receptor bevinden.
Activering verbindt de hydroxylgroepen van tyrosineresten van de receptor met fosfaatgroepen (fosforylering). Deze fosforylering creëert herkenningsplaatsen voor intracellulair gelokaliseerde eiwitten die er vervolgens aan kunnen binden. Dit doen ze via specifieke sequenties (SH2-domeinen). Na binding aan de fosfaatgroepen worden in de celkern zeer complexe signaalcascades geactiveerd, die op hun beurt tot fosforylering leiden.
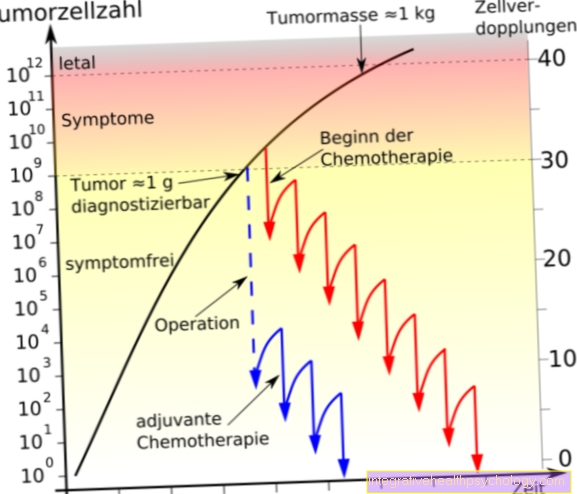
Opgemerkt moet worden dat de activiteit van eiwitten in beide richtingen kan worden beïnvloed via fosforylering door tyrosinekinasen. Deze kunnen enerzijds worden geactiveerd, maar anderzijds ook gedeactiveerd. Te zien is dat een onbalans van de tyrosinekinase-activiteit kan leiden tot een overstimulatie van groeifactor-geassocieerde processen, waardoor lichaamscellen zich uiteindelijk kunnen vermenigvuldigen en dedifferentiëren (verlies van cellulair genetisch materiaal). Dit zijn de klassieke processen van tumorontwikkeling.
Defecte regulatiemechanismen van tyrosinekinasen spelen ook een beslissende rol bij de ontwikkeling van diabetes mellitus (insulinereceptor), arteriosclerose, pulmonale hypertensie, bepaalde vormen van leukemie (vooral CML) of niet-kleincellige longkanker (NSCLC).
Lees hier alles over het onderwerp: Tumorziekten.
Wat is de tyrosinekinasereceptor?
De tyrosinekinasereceptor is een op membranen gebaseerde receptor, dat wil zeggen een receptor die verankerd is in het celmembraan en structureel gezien een receptor met een transmembraancomplex. Dit betekent dat de receptor door het hele celmembraan trekt en ook een extra- en intracellulaire kant heeft.
De specifieke ligand bindt aan de receptor aan de extracellulaire kant, de alfa-subeenheid, terwijl het katalytische centrum van de receptor zich aan de intracellulaire kant bevindt, de β-subeenheid. Het katalytische centrum vertegenwoordigt het actieve gebied van het enzym, waar specifieke reacties plaatsvinden.
Zoals hierboven al vermeld, bestaat de structuur van de receptor meestal uit twee eiwitsubeenheden (dimeren).
In het geval van de insulinereceptor binden de twee alfa-subeenheden bijvoorbeeld de insulineligand. Na ligandbinding worden fosfaatgroepen (zogenaamde fosforylering) gebonden aan specifieke tyrosineresten (hydroxylgroepen). Dit genereerde de tyrosinekinase-activiteit van de receptor. In het volgende kunnen verdere substraateiwitten (bijv. Enzymen of cytokinen) in de cel worden geactiveerd of geïnactiveerd via hernieuwde fosforylering, waardoor celproliferatie en differentiatie worden beïnvloed.
Wat is een tyrosinekinaseremmer?
Zogenaamde tyrosinekinaseremmers (ook: tyrosinekinaseremmers) zijn relatief nieuwe geneesmiddelen die kunnen worden gebruikt om specifiek een defecte tyrosinekinaseactiviteit te behandelen. Ze zijn geclassificeerd als chemotherapeutische middelen en vinden hun oorsprong in de late jaren negentig en vroege jaren 2000. Ze kunnen in verschillende generaties worden ingedeeld en worden gebruikt bij de behandeling van kwaadaardige ziekten.
Functioneel kunnen specifieke processen worden voorkomen door ongebalanceerde tyrosinekinase-activiteiten. Hierbij zijn in principe vier verschillende werkingsmechanismen mogelijk. Naast concurreren met ATP is ook binding aan de fosforyleringseenheid van de receptor, aan het substraat of allosterisch buiten het actieve centrum mogelijk. Het effect van de tyrosinekinaseremmers wordt teweeggebracht door binding aan de EGF-receptor en de daaropvolgende remming van de enzymatische activiteit van de tyrosinekinasen.
In termen van medische geschiedenis bereikte de ontdekking van het actieve ingrediënt imatinib als een tyrosinekinaseremmer een uitstekende positie. Het wordt specifiek gebruikt bij chronische myeloïde leukemie (CML), waar het de tyrosinekinaseactiviteit onderdrukt die pathologisch wordt gecreëerd door een chromosoomfusie (Philadelphia-chromosoom door fusie van chromosomen 9 en 22).
In de afgelopen jaren zijn verschillende andere tyrosinekinaseremmers ontwikkeld. De momenteel bestaande 2e generatie bevat ongeveer tien tyrosinekinaseremmers.
Lees hier meer over het onderwerp:
- Gerichte chemotherapie met tyrosinekinaseremmers
- Chronische myeloïde leukemie.
Voor welke indicaties worden ze gebruikt?
Tyrosinekinaseremmers worden gebruikt voor verschillende kwaadaardige ziekten. Imatinib wordt met name gebruikt bij chronische myeloïde leukemie. Andere mogelijke toepassingen zijn niet-kleincellige longkanker (NSCLC), borstkanker en darmkanker.
Vanwege het zeer selectieve aanvalsmechanisme van de tyrosinekinaseremmers worden ze gewoonlijk beter verdragen dan conventionele chemotherapeutische middelen. Desalniettemin zijn ook hier in detail bijwerkingen te verwachten.
Lees meer over: Longkanker.